Что такое старение и как его избежать

Тема возможного продления жизни и замедления старения сейчас явно в тренде. В СМИ и на научно-популярных площадках регулярно упоминаются новые случаи успешного продления жизни лабораторных животных. Раздаются оптимистичные прогнозы, что если не через 10 лет, то в XXI веке старение точно будет остановлено, без чего, само собой, не обходятся и площадки вроде TED Talks.
Некоторые общественные деятели призывают направить основополагающие ресурсы общества на победу над старением, утверждая, что на исследования выделяется недостаточно денег, и требуется повышенное внимание к этой проблеме. Илья Ясный, руководитель экспертного отдела биофармацевтического венчурного фонда, кандидат химических наук, рассматривая историю и текущее состояние теорий старения, эксперименты по продлению жизни животных, исследования людей-сверхдолгожителей и сложность системы разработки лекарств представляет взвешенный взгляд на проблему разработки методов борьбы со старением.

Почему я считаю, что инвестировать в разработку лекарств от старения преждевременно
Я сразу должен сказать, что это не научная статья, а мой субъективный взгляд как эксперта по разработке лекарств и инвестированию. Я ни в коей мере не призываю отказаться от изучения механизмов старения и попыток на них повлиять, не утверждаю, что это малозначимая или ненужная задача. Однако я хочу создать некий противовес сверхоптимистичным и зачастую просто безответственным заявлениям о том, что ключ от загадки старения у нас почти в руках и учёные вот-вот создадут терапевтические средства, которые позволят либо радикально продлить жизнь, либо не дряхлеть до весьма почтенного возраста.
Я предполагаю, что эта статья вызовет определённую критику среди тех, кто занимается созданием лекарств от старения, — это было бы здорово, так как позволит мне либо пересмотреть мои взгляды, либо укрепить свою позицию.
Здоровое долголетие и радикальное продление жизни
Насколько мне известно, исследования старения (anti-aging research) делятся на два направления, имеющих целью:
- обеспечение здоровой старости, при которой последствия дряхления сведены к минимуму, но продолжительность жизни существенно не удлиняется по сравнению с нормальной (средней);
- продление средней продолжительности жизни на 20% и более по сравнению с нынешней, достигнутой в развитых странах.
Моё главное возражение против победных реляций насчёт разработки таких лекарств — это то, что уровень фундаментальной науки и понимания механизмов старения недостаточен для их разработки рациональным способом.
Интересно сравнить ситуацию в области изучения старения с рядом многофакторных заболеваний, часть из которых поддаётся терапии, а часть — нет. К первым относятся, например, некоторые виды рака, ряд аутоиммунных заболеваний (ревматоидный артрит, псориаз, рассеянный склероз), некоторые виды заболеваний сердца. Ко вторым — практически все нейродегенеративные заболевания (болезнь Альцгеймера, Паркинсона, инсульт и другие), диабет I типа, некоторые разновидности гепатита, многие фиброзы.
Видно, что прогресс в фармакотерапии тех заболеваний, где он был достигнут, стал следствием длительных фундаментальных исследований, параллельно с прогрессом биомедицинской науки в целом. Так, программа борьбы с раком началась в США в 1950-е годы и до 1990-х не приносила ощутимых плодов. Однако в 2000–2010-х годах был достигнут невиданный прогресс в лечении отдельных видов рака. На рынок вышел ряд препаратов, разработанных на основе глубокого понимания процессов онкогенеза, функционирования нормальных клеток и взаимодействия систем организма с опухолью. Но даже с учётом достигнутых успехов количество провалов в области разработки онкологических препаратов выше, чем во многих других.
Естественно, за последние десятилетия достигнут огромный прогресс во всех областях биологии и медицины. Однако учёные пока далеки от того, чтобы предложить хотя бы грубую концептуальную модель причин и механизмов старения, с которой согласилось бы большинство исследователей.
Такая модель должна быть достаточно последовательной и всеобъемлющей, чтобы наконец дать какие-то ощутимые и воспроизводимые результаты. Ниже я коротко рассмотрю ряд концепций, которые являются более-менее признанными сейчас. Главенствующие концепции в данной области сменяются достаточно часто, и это один из косвенных признаков того, что область находится на начальном этапе. Правда, каждая такая концепция объявляется решением вопроса и ключом к созданию лекарств от старения. Только на моей памяти за 15 лет их сменилось минимум 3–4 штуки.
Я не собираюсь критиковать теории старения, так как не являюсь специалистом в этой области. Но я попробую показать, почему ни одна из них пока не доросла до того уровня, чтобы на её основе можно было рационально создавать лекарства.
Нынешние и прошлые теории старения
Долгое время, до середины XX века, старение рассматривалось как побочный процесс нормальной жизнедеятельности, что-то вроде износа автомобиля. Стало понятно, что по мере старения в клетках организма накапливаются мутации, и предполагалось, что они накапливаются случайно, постепенно приводя к ухудшению функционирования клеток, развитию заболеваний и смерти.
Однако с 1950-х годов стали появляться исследования, противоречащие такой точке зрения. Появились свидетельства того, что старение — это некая адаптация, выработанная в процессе эволюции. Цель этой адаптации до сих пор не ясна.
Есть свидетельства того, что старение может защищать организм от злокачественных заболеваний. Есть теория, что старение и смерть как-то связаны с необходимостью защищать популяцию от инфекций. Факт в том, что старение, судя по всему, — не полностью стохастический (случайный) процесс, а хотя бы отчасти контролируемый. Так, теломеры — повторяющиеся участки ДНК на концах хромосом, которые укорачиваются с каждым делением клетки — ограничивают количество делений, которые может претерпеть клетка. После 50–60 делений (так называемое число Хейфлика) клетка перестаёт делиться и переходит в состояние сенесцентности. Однако половые клетки в ходе эмбриогенеза, а также зигота после оплодотворения способны «откатить» эти изменения и делиться снова — фактически бесконечно.
Эти и другие факты с конца 1980-х годов дают повод ряду исследователей говорить о том, что старение — это программа.
Старение — это программа
Это одно из самых популярных на сегодня утверждений, которое сразу создаёт у аудитории ощущение аналогии с компьютерной программой. Собственно, так прозелиты борьбы со старением и заявляют: «Старение — программа, а значит, как и любую программу, её можно взломать». Появился даже термин «биохакинг», который явно отсылает ко взлому компьютерных программ. В этой ситуации особенно выпукло видна недооценка сложности живого организма.
Биохакеры считают, что допустимо принимать лекарственные препараты и биологически активные добавки с недоказанной эффективностью, руководствуясь теоретическими соображениями или результатами экспериментов на животных. Между тем, вся практика разработки лекарств говорит о том, что более чем в 99% случаев то, что работает на животных, не будет работать на человеке. Эксперименты на животных, однако, всё равно необходимы, так как без них процент неудач был бы ещё выше. Ниже я расскажу о том, с какими проблемами сталкиваются разработчики лекарств при переходе от животных к человеку и какие усилия необходимы в ходе клинических исследований, чтобы доказать эффективность и безопасность лекарства.
Впрочем, даже если старение — действительно тонко налаженный запрограммированный механизм, из этого совершенно не следует, что мы можем его «взломать», не нанеся вреда жизнедеятельности организма. Этот механизм появился в ходе миллионов лет эволюции, и «взломать» его может оказаться не проще, чем вырастить человеку крылья.
Эпигенетика
Одна из самых популярных сегодня концепций запрограммированного старения — эпигенетическая. Речь идёт о том, что в клетке ДНК подвергается не только мутированию, но и химической модификации, в ходе которой происходит включение и выключение генов и регуляторных областей. Например, гены, которые работают в ходе эмбриогенеза, отключаются во взрослом организме.
Оптимизм разработчиков лекарств против старения связан с открытием факторов Яманаки — четырёх белков, которые участвуют в процессе транскрипции ДНК (Oct4, Sox2, Klf4 и c-Myc) и повышенная экспрессия которых в клетке приводит к «эпигенетическому откату»: клетка приобретает черты стволовых клеток и способна превращаться в клетки других типов. Проблема в том, что каждый из этих факторов (которые ещё далеко не до конца изучены) — сильный онкоген, то есть их активация может привести к злокачественному перерождению клетки.
Это логично, так как раковые клетки имеют много общего с эмбриональными и стволовыми клетками: они активно делятся, более подвижны, восприимчивы к факторам роста и у них экспрессируется сходный ряд белков (которые так и называют — раковые эмбриональные антигены, cancer embryonic antigens, CEA). Также для раковых клеток характерна активация теломеразы, поэтому попытки справиться со старением путем инъекции теломеразы или её гена чреваты и увеличением частоты появления злокачественных опухолей. Кроме того, корреляция длины теломеров с долгожительством подтверждается не во всех исследованиях.
В целом, если даже безопасный эпигенетический откат возможен — он должен, вероятно, затрагивать сотни генов очень избирательным образом, а для этого у нас сейчас нет технических возможностей. Маловероятно, что факторы Яманаки или ещё какие-то белки работают как «мастер-регуляторы», которые управляют всей сложнейшей системой, связывающей воедино эмбриогенез, старение и рак.
Если бы это было возможно, встречались бы экстремальные долгожители с мутациями в генах таких регуляторов, однако мы не знаем случаев, чтобы люди жили существенно дольше 120 лет. Как уже говорилось, человеческие клетки дважды претерпевают эпигенетическое обновление: сразу после оплодотворения яйцеклетки и в процессе развития половых клеток в эмбриогенезе. В обоих случаях происходит полное удаление маркеров дифференцировки и переход клетки в плюрипотентное состояние. Таким образом в природе не наблюдается омолаживание с сохранением дифференцированного фенотипа.
Тем не менее, эксперимент доктора Бельмонте даёт надежду, что в принципе омолаживающего эффекта добиться возможно. По крайней мере, это удалось сделать у генетически модифицированных мышей с преждевременным старением, скрестив их с мышами, у которых под воздействием антибиотика доксициклина вырабатывались факторы Яманаки. Правда, как я покажу ниже, между этим экспериментом и применением подобных технологий у людей огромная пропасть. Удастся ли её преодолеть — покажет время.
Сенесцентные клетки
После того как было обнаружено, что сенесцентные клетки выделяют ряд провоспалительных факторов, которые могут способствовать развитию заболеваний, связанных со старением, возникла идея избирательно уничтожать их. Однако успеха на этом пути пока достигнуто не было: не найдено маркеров, достаточно уникальных для сенесцентных клеток, — все подобные методы в той или иной степени будут затрагивать нормальные функциональные клетки организма, а значит, приводить к побочным эффектам.
Если уж раковые клетки, которые сильнее отличаются от здоровых, чем сенесцентные, не удаётся уничтожать избирательно, то надежда на избирательное уничтожение сенесцентных совсем призрачна. Тем не менее, одна из компаний, Unity Biotechnology, собрала уже почти 300 млн долларов и начала клиническое исследование «сенолитика» по остеоартриту. В ближайших планах компании нет разработки лекарств от старения, а использование понятия «сенесцентные клетки» и age-related diseases (болезни, ассоциируемые со старением) выглядят как buzzwords (специальный термин, произносимый с целью произвести впечатление на дилетантов) для привлечения неспециализированных инвесторов.
Другая проблема состоит в том, что, как уже говорилось, сенесценция, возможно, возникла как защита от онкологических заболеваний. Различные эксперименты на животных в отношении взаимодействия сенесцентных и раковых клеток дают противоречивые результаты, поэтому вопрос о том, онкогенные они или нет, пока остаётся открытым.
Антиоксиданты
Длительное время считалось, что основная причина накопления мутаций в организме — избыточное количество активных форм кислорода, приводящих к образованию свободных радикалов. Действительно, множество данных указывает на то, что и клеточная сенесценция, и онкологические заболевания, и объём повреждения мозга при инсульте, и многие другие процессы ассоциированы с окислительным стрессом.
Естественно, предпринимались многочисленные попытки разработать антиоксиданты, которые помогали бы при старении и различных заболеваниях. Все они пока потерпели неудачу. Трудно сказать, в чём тут дело: возможно, того количества витамина С (сильного антиоксиданта) которое люди обычно получают с пищей, и так достаточно, чтобы справиться с окислительным стрессом. Может быть, дело в том, что окислительный стресс включает защитные механизмы клетки, а введение антиоксиданта затормаживает такие процессы. А может быть — это всего лишь симптом поздней стадии развития патологического процесса, и бороться с ним бесполезно. В любом случае, вот прекрасная иллюстрация того, что никакая стройная концепция, даже многократно валидированная на клетках и животных, не может считаться доказанной, пока не проведены масштабные и подробные исследования на людях.
На примере истории с антиоксидантами хорошо видно, как первоначальный оптимизм разработчиков лекарств от старения, которым в очередной раз кажется, что «они всё поняли», утихает, а лекарства, уже поспешно названные «таблеткой от старости», находят свою нишу в сфере БАДов и косметики, где никто не требует строгих научных доказательств их эффективности.
Ещё один яркий пример — недавняя история с NMN, предшественником NAD+. NAD+ — очень распространенная молекула в живых клетках, служащая коферментом множества окислительно-восстановительных реакций. Причем NAD+ и производится человеческими клетками, и поступает извне, например, образуясь из витамина B3.
Группа учёных из Австралии и США под руководством Дэвида Синклера опубликовала статью, в которой была открыта роль NAD+ в регуляции связывания двух белков, DBC1 и PARP1 у мышей. Было известно, что PARP1 играет важную роль в репарации ДНК. Учёные обнаружили (в эксперименте на шести мышах — по три в группе), что NAD+ с возрастом становится меньше, поэтому предположили, что увеличение уровня NAD+ в клетке приведёт к «омоложению». Далее они обнаружили, что уровень репарации ДНК после недели ежедневных внутрибрюшинных инъекций NMN мышам вырос, увеличилась активность PARP1. Авторы также пишут о «защите старых мышей от изменений в количестве лимфоцитов и гемоглобина», но, на мой взгляд, особой разницы нет, особенно если удалить явно выпавшие точки:
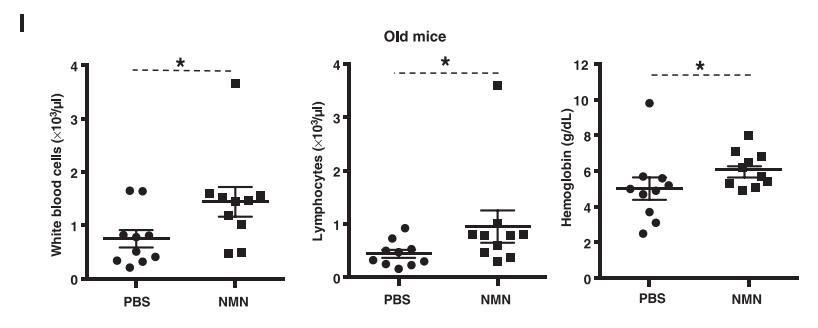
Изменение количества лейкоцитов, лимфоцитов и гемоглобина у старых мышей при введении NMN
Получилась неплохая фундаментальная работа, проливающая свет на некоторые аспекты молекулярной биологии клетки, связанные с репарацией ДНК. До этого момента всё было хорошо. Но Дэвид Синклер имеет нескромность заявлять, что его группа совершила «гигантский скачок в борьбе со старением»! Что «клетки старых мышей стали неотличимы от клеток молодых всего через неделю терапии»! И что через 3–5 лет чудо-таблетка появится на прилавках! Можно подумать, что NMN, витамин В3 и ниацин уже не продаются за копейки. Кстати, сам NAD+ уже провалился по болезни Паркинсона.
Я так подробно разобрал этот пример, потому что он весьма типичен и повторяется с завидной периодичностью.
Метформин
Замечательный препарат, одобренный для лечения диабета II типа, с очень сложным и не до конца изученным механизмом действия.
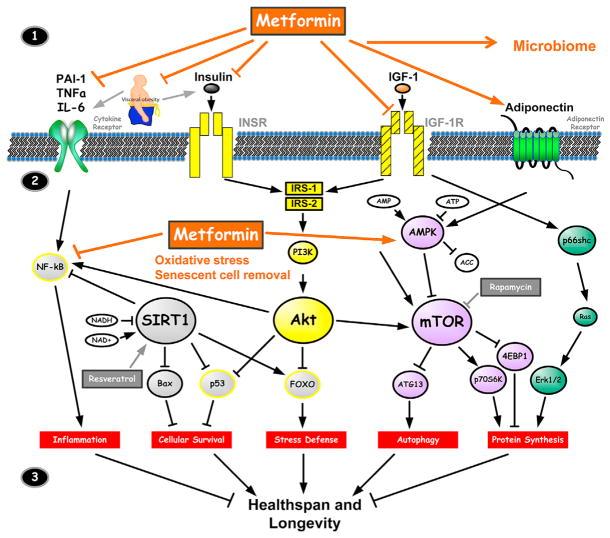
Механизм действия метформина в отношении старения
Некоторые исследователи добивались удлинения жизни модельных животных аж на 40%. Такие данные вселили оптимизм в группу американских учёных, которые начали исследование на 3000 пациентах, половина в группе метформина, половина — плацебо.
Первичным критерием служит наступление смерти или тяжёлых заболеваний: инсульта, инфаркта, рака, диабета, болезни Альцгеймера. На все эти исходы влияет настолько много факторов, что есть большое опасение: эффект метформина будет совершенно незаметен на фоне всех остальных факторов. В частности, после набора пациентов в исследование они станут следить за собой гораздо лучше, питаться лучше, и в итоге велика вероятность, что в группе плацебо результаты будут такими же, как и в группе метформина.
Это лишний раз подтвердит: давно известно, как продлить жизнь: правильно питаться, заниматься физкультурой, жить в экологически чистом районе. Для понимания механизмов старения исследование ничего нового не даст.
Другие подходы
Упомяну несколько других подходов в борьбе со старением, на которые возлагались и возлагаются большие надежды.
Рапамицин — один из ингибиторов mTOR, важного внутриклеточного регулятора метаболизма, пролиферации и энергетического баланса клетки. Рапамицин используется для профилактики отторжения трансплантированных органов из-за своих иммуносупрессорных свойств. После того, как оказалось, что он продлевает жизнь мышам, возникла идея использовать его для этих же целей у человека. В клиническом исследовании применяли аналог рапамицина эверолимус (используется при лечении ряда метастатических раков). Авторы утверждают, что в низких дозах он оказал благоприятный эффект на функционирование иммунной системы у пожилых. Впрочем, вряд ли эверолимус, как и рапамицин, можно будет использовать для продления жизни, так как перечень его побочных эффектов очень широк и включает гиперхолестеринемию, гиперлипидемию, вирусные, бактериальные, грибковые инфекции, сепсис, отёки, абдоминальную боль и другие.
Омоложение состава крови — подход, практиковавшийся издревле, и внезапно получивший новую жизнь на волне нынешнего интереса к продлению жизни. Снова — переливание плазмы крови молодых мышей старым, а также введение старым мышам плазмы пуповинной крови человека показало улучшение молекулярных признаков старения и когнитивных показателей. Однако при переходе к человеку опять не удалось повторить этот успех. В исследовании на 18 пациентах с болезнью Альцгеймера ни у одного из них не наблюдалось когнитивных улучшений.
На стволовые клетки всё ещё возлагают большие надежды в плане лечения различных заболеваний — аутоиммунных, нейродегенеративных. Многие из них возраст-зависимые, поэтому некоторые исследователи считают стволовые клетки перспективными и в плане борьбы со старением. Однако до сих пор только трансплантация гематопоэтических стволовых клеток при ряде гемобластозов (злокачественных заболеваний кроветворной системы) и ряде наследственных заболеваний доказала свою эффективность и успешно применяется с 1970-х годов.
Опять же, теоретические предпосылки прекрасны — стволовые клетки обладают регенеративным потенциалом, способны сами мигрировать в область повреждений и у животных показывали эффективность в лечении множества заболеваний, в том числе замедляя старение. Однако при переходе к клиническим исследованиям, как всегда, эффективности не удалось добиться почти нигде. Проводилось даже исследование применения стволовых клеток против старения, которое не подтвердило их эффективность, несмотря на утверждение авторов статьи.
Некоторую эффективность стволовые клетки показали при одном виде воспалительного заболевания кишечника, есть некоторые данные по эффективности при болезни «трансплантат против хозяина» и хронической сердечной недостаточности. Также существуют опасения и по безопасности: даже если стволовые клетки не способны образовывать опухоли сами по себе, они могут спровоцировать рост микроопухолей начальной стадии или метастазирование первичной опухоли. В доклинических исследованиях стволовые клетки иногда ухудшали симптомы заболеваний, которые ими пытались лечить. Пока что недостаточно знаний и данных, чтобы решить все эти проблемы.
Тем не менее, множество клиник по всему миру предлагают «лечение» стволовыми клетками, обещая успех. В связи с их недоказанной эффективностью и безопасностью FDA выпустило предупреждение о недопустимости использования клеточных средств регенеративной медицины с недоказанной эффективностью и безопасностью.
Обобщение
Приведённый выше далеко не полный список концепций, лежащих в основе современной разработки лекарств от старения, свидетельствует о том, что у каждой из них есть слабые стороны. Ловушка, в которую попадают многие исследователи, — чрезмерное упрощение теоретических моделей, редукционистский, механический подход.
У каждого процесса в организме — множество связанных процессов, и не бывает так, чтобы удалось повлиять только на один из них. К тому же, все эти процессы контекстно зависимы: в организме человека 3,7·1013 клеток, каждая из которых отличается от другой и генетически и фенотипически, и каждую секунду во многих из них происходят изменения. То, что некоторые лекарства удается разрабатывать рациональным способом и они вообще кому-то помогают, — большое достижение фундаментальной науки и всегда — большая удача.
Так, все потенциальные молекулярные мишени, которые упоминались выше, и прочие, которые используются для борьбы со старением, плейотропны, то есть их функции не ограничиваются чем-то одним, а иногда бывают противоположны. Например, с одной стороны, ингибирование сигналинга инсулинового фактора роста (IGF-1) и гормонов роста должно приводить к защите от окислительного стресса, старения и злокачественных заболеваний. С другой — это необходимые факторы нормального функционирования организма: поддержания мышечной массы, метаболизма и других жизненно важных процессов.
Об онкогенности факторов Яманаки я уже говорил выше. Мышиные нокауты mTOR (мишени рапамицина и эверолимуса) летальны. Воспаление может быть как благоприятным фактором, активирующим иммунную систему и способствующим элиминации раковых клеток, так и играть онкогенную роль, поскольку факторы воспаления являются для раковых клеток сигналами для пролиферации и метастазирования. Стволовые клетки используют различные механизмы защиты от онкогенных мутаций не только у разных видов животных (человека, мышей), но даже у одного организма стволовые клетки разных видов используют разные механизмы. В результате исследователи получают противоречивые результаты в зависимости от того, как поставят эксперимент.

В попытках понять, почему некоторые люди живут дольше, чем другие, проводились исследования долгожителей и сверхдолгожителей (старше 110 лет). Очевидно, у них меньше частота сердечно-сосудистых заболеваний и рака, однако причины пока не выяснены. По крайней мере, можно утверждать, что долгожительство имеет существенную генетическую компоненту.
Некоторые исследования показали, что полиморфизмы в генах рецептора IGF1 и транскрипционного фактора FOXO34 ассоциированы с долгожительством, другие исследования выявили снижение содержания гаплотипа ApoE45 у людей старше 100 лет, однако все эти корреляции не стопроцентны. Полногеномное секвенировение сверхдолгожителей показало, что никаких «генов долгожительства» у них, скорее всего, нет: мутации, которые обычно ассоциированы с долгожительством, у них отсутствовали, и наоборот, у некоторых присутствовали варианты генов, ассоциированные с сердечно-сосудистыми нарушениями. Это лишняя иллюстрация того, насколько поиск генных ассоциаций — ненадёжное, а часто и бессмысленное дело.
Конечно, постепенно успехи в single-cell технологиях приоткрывают завесу сложности, окружающую генотип, фенотип и судьбу отдельных клеток. Например, оказывается, образцы ДНК, взятые из различных клеток опухоли, отличаются друг от друга, как ДНК опухолей разных людей. И все эти различия усугубляются быстрой динамикой изменений, за которыми мы вообще пока не можем следить.
Много оптимизма в сообщество разработчиков лекарств против старения вселили исследования голого землекопа. Этот грызун обладает нехарактерной для своего небольшого размера продолжительностью жизни — 30 и более лет — и у него редко наблюдаются злокачественные заболевания. Безусловно, изучение голого землекопа может дать (и уже даёт) массу информации о природе и механизмах старения. В частности, понятно, что у этого вида в ходе эволюции сформировались такие защитные механизмы, препятствующие развитию рака, которых нет у человека и других млекопитающих. Значит ли это, что мы в скором времени сможем создать новый метод генной терапии, который позволит изменить клетки человека, чтобы они медленнее старели? Не думаю. Тут мы переходим к очень важной теме: насколько данные, полученные на животных, позволяют прогнозировать воздействие терапии на человека?
Разработка лекарств от старения. Релевантность доклинических моделей
По международным стандартам все лекарства перед применением на людях проверяются на животных на безопасность и эффективность. Если в отношении безопасности они очень строгие и, как правило, предписывают тестирование на здоровых мышах и макаках, то с эффективностью всё гораздо сложнее. Для того чтобы имитировать действие лекарства на человека, создаются доклинические модели заболеваний. Чаще всего в качестве модельных организмов используются мыши, но и другим видам животных достаётся.
Для некоторых заболеваний и типов лекарств существуют достаточно валидированные модели, в том смысле, что работавшее на доклинической модели, работает и на человеке, и наоборот, то, что не показывает эффективности у животных, не работает у человека. Таких моделей совсем немного — слишком уж отличаются организмы модельных животных от человека. Так, между иммунной системой мыши и человека существует огромная разница, мозг мыши также сильно отличается от мозга человека, соответственно, продолжительность жизни, причины смертности и другие параметры делают мышей очень ненадёжными для моделирования многих человеческих заболеваний. Например, мыши в основном умирают от рака и очень редко — от нейродегенеративных и сердечно-сосудистых заболеваний.
Кроме того, как правило, лекарства тестируются на генетически однородной популяции животных одного возраста, которые содержатся в одинаковых условиях, едят одну пищу и не болеют сопутствующими заболеваниями. Нет ничего удивительного, что при переходе к пациентам разного возраста, пола, расы, с разными историями болезней эффекты множества лекарств размываются.
Другой проблемой становится недостаточно корректное применение даже неплохих моделей. Так, до сих пор во многих доклинических экспериментах не используется рандомизация, ослепление, подсчёт статистической мощности и обоснование размера выборки, что давно стало стандартом для клинических исследований. Всё это приводит к тому, что множество результатов исследований на животных не воспроизводится при проверке в независимых лабораториях. Поэтому к сенсационным данным исследований нужно относиться с большой осторожностью, пока они не подтверждены другой исследовательской группой.
Зачастую лекарства применяются не в том режиме, в котором затем планируется использовать их у пациентов, а измеряемые параметры не соответствуют клиническим. В итоге очень часто эффективность лекарств в доклинических исследованиях переоценивается. Так, у мышей болезнь Альцгеймера или инсульт научились лечить очень хорошо сотнями разных лекарств, ни одно из которых не показало эффективности в клинических исследованиях (то есть на людях).
Поэтому очередное сообщение о том, что лекарство от старости продлило жизнь мышам (тем более, дрозофилам или нематодам) на 40 или 80% воспринимается с большим скепсисом. А ведь многие заболевания, которые пытаются моделировать у мышей, связаны со старостью. Смерть человека наступает не от «старения вообще», а от отказа какого-то конкретного органа — чаще всего сердца, легких, мозга. Если на данный момент не удаётся смоделировать воздействие на эти органы даже по отдельности, можно ли надеяться создать модель старения организма в целом, который намного сложнее суммы своих частей? В этом контексте популярные сейчас споры, является ли старение болезнью, с точки зрения разработки лекарств не имеют никакого смысла.
Тем не менее, мышиными моделями имеет смысл пользоваться, чтобы отфильтровать заведомо неработающие подходы. Как правило, если какое-то лекарство не помогает даже мышам, нет смысла пытаться тестировать его на человеке, хотя и здесь есть некоторый риск выплеснуть с водой ребенка.
Клинические исследования
В разработке лекарств, в том числе от старения, нередка ситуация, когда исследователи настолько переоценивают свой продукт, что ищут подтверждения своей теории и игнорируют подводные камни и критические моменты. Им нелегко бывает отказаться от своей любимой концепции и остановить разработку препарата. Собрав необходимый пакет доклинических данных и проведя пару исследований на животных, которые подтверждают теорию, разработчики переходят к клиническим исследованиям. Иногда бывает даже так, что проводят несколько десятков исследований на животных и выбирают из них те, которые выставляют продукт в наилучшем свете.
Я, будучи сотрудником инвестиционного фонда, просмотрел тысячи таких проектов и всегда пропагандирую обратный подход: надо постараться «убить» препарат как можно раньше, проводя killer experiments («убийственные» эксперименты) — то есть такие, в которых лекарство тестируется в наиболее невыгодных для него условиях. Например, лекарство от инсульта нужно тестировать на старых животных с сопутствующими заболеваниями и давать его не перед или сразу после инсульта, а через три часа. Если препарат пройдёт эту проверку, риски провала будут снижены, а если нет — тем лучше: разработчик сэкономит деньги и время и сможет заняться чем-нибудь более полезным.

Зачастую на ранних стадиях клинических исследований, когда тестируется безопасность продуктов и подбирается доза, не удаётся ни доказать, ни опровергнуть гипотезу об эффективности лекарства. Даже вторая фаза клинических исследований, в которой эффективность, как правило, измеряется, не даёт окончательного ответа в силу малого размера выборки, отсутствия ослепления, тщательного подбора пациентов, в силу чего исследуемая группа становится слишком однородной.
Особенно в этом плане ненадёжны исследования, где в качестве критерия используются не объективные показатели (такие как выживаемость, наличие опухоли в онкологии, кожное поражение при псориазе), а субъективные шкалы опроса пациентов — шкала боли, когнитивных нарушений и т.п. Разброс данных в таких шкалах тем больше, чем больше выборка пациентов, и на них огромное воздействие оказывают индивидуальные особенности пациентов, вплоть до того, что сам факт включения пациента в исследование может оказать влияние на результаты.
Окончательной проверке лекарство подвергается в третьей фазе, которая может стоить несколько сотен миллионов долларов и занимать несколько лет. Чем сложнее болезнь, тем дороже обходится проверка лекарства на эффективность и тем больше времени она занимает.
Негативным экстремальным примером в данном случае является болезнь Альцгеймера — уверенность разработчиков в своих препаратах привела к многочисленным провалам в третьей фазе антител против белка амилоид-бета, который считали причиной болезни.
Причём ситуация с неясной эффективностью лекарств выгодна в короткой перспективе всем: врачи и менеджеры компаний получают свою зарплату и бонусы, пациенты включаются в исследования, где за ними лучше ухаживают, разработчики продают свои продукты крупным компаниям. Только вот в далёкой перспективе — это миллиарды долларов и время, которое было потрачено впустую на слепые попытки, основанные на иллюзии понимания процессов, происходящих в организме. Когда происходит провал, разработчики разводят руками и говорят: «Что же вы хотели? Это наука».
Нечто похожее сейчас начинается и в области старения. Шумиха вокруг этой модной темы и невозможность опровергнуть заявления разработчиков позволяют годами заниматься такими исследованиями, пожирая деньги инвесторов, в том числе государственных, и ни за что не отвечая. С таким показанием, как «старение», дело обстоит совсем плохо. В силу того, что стареют все, разнообразие популяции «пациентов» здесь максимально. Следовательно, вариабельность изучаемых параметров также максимальна. Соответственно, чтобы достичь необходимой статистической мощности исследования (грубо говоря, чтобы «поймать» эффект от препарата, если он действительно работает) нужны будут огромные выборки пациентов — вероятно, десятки тысяч (кстати, для исследований в области кардиологии 15 000–20 000 пациентов — не редкость). И наблюдать за ними нужно будет десятилетиями, так как, конечно, эффект от препарата не проявится сразу. А если препарат вдруг провалится, всегда можно будет сделать анализ по подгруппам и найти такую подгруппу (поможет эффект множественных сравнений), в которой он будет «эффективен» — например, белые женщины старше 50, больные диабетом.
Для того чтобы исследования всё-таки были не такими длинными и масштабными, учёные пытаются найти биомаркеры старения — биологические параметры, которые бы коррелировали со старением. В качестве таких маркеров предлагается использовать индекс дряхлости (frailty index), состояние иммунной системы, эпигенетические маркеры, биохимический состав крови. Правда, валидация биомаркера, то есть определение его способности прогнозировать состояние организма, наталкивается на ещё большие проблемы, чем разработка лекарств. В силу вариабельности маркеров требуются огромные когорты пациентов как для поиска маркеров, так и для последующего доказательства их валидности в строгих исследованиях. При этом всё равно неизбежно некоторое количество ложноположительных и ложноотрицательных результатов, которое будет отражаться на последующем использовании этих маркеров.
Сравнительное исследование долгожителей в Японии не выявило корреляции долгожительства со многими ожидаемыми параметрами: оно не коррелировало с длиной теломеров, маркерами иммуносенесцентности, почечной и печеночной функцией. Зато обнаружилась парадоксальная положительная корреляция между наличием слабого хронического воспаления и смертностью, а также функциональными возможностями и когнитивными функциями. При этом в более раннем возрасте системное воспаление — сильный предиктор смертности, то есть получается, что люди, пережившие определённый порог, выживают затем дольше при определенном уровне маркеров воспаления. Впрочем, этот факт нельзя использовать для разработки лекарств, зато он наглядно показывает, насколько сложны и индивидуальны сети взаимодействий в организме.
Выводы. Что же делать в такой сложной ситуации с разработкой лекарств против старения?
Продолжать и усиливать фундаментальные исследования физиологии человека и животных, процессов старения у них, признавая, что мы находимся в самом начале пути и ещё не знаем очень многого. Почему в 2000–2010 году произошла революция в лечении некоторых видов рака, и наконец стало возможным излечение пациентов на поздней стадии болезни? Потому что с 1950-х годов, в первую очередь в США, вкладывались огромные деньги в фундаментальные исследования рака, которые попутно позволили разработать множество революционных методов и сделать массу открытий. До 1990-х годов ощутимых практических плодов это не приносило.
С большим скептицизмом относиться к заявлениям типа:
- скоро будет взломана программа старения;
- таблетка от старости появится на прилавках через 3–5 лет;
- учёные совершили революцию в области борьбы со старением;
- я принимаю метформин, витамины и кучу БАДов по совету учёных, все делайте то же самое.
Необходимо помнить, что одних теоретических предпосылок недостаточно для утверждений об эффективности терапии. То, что какое-то лекарство оказалось эффективно у животных, — также не доказательство правильности концепции. В большинстве случаев надежды на будущую эффективность не оправдываются.
Наряду с добросовестными исследователями в этой области подвизается много шарлатанов и людей, склонных преувеличивать свои успехи и успехи в области в целом. Следует избегать любых подходов, врачей и клиник, которые обещают «вернуть молодость» с помощью «новейших научных методов» клеточной терапии или «очистки» организма. Вообще, необходимо развивать у себя навыки критического мышления и, подобно трёхлетнему ребенку, не стесняться спрашивать: почему и как.
Повысить продолжительность жизни на Земле в среднем можно гораздо проще, чем с помощью генного программирования или переливания молодой крови. В развитых странах это уже сделали; в большинстве развивающихся стран она не превышает 55 лет, а правильная организация здравоохранения и повышение уровня жизни позволяют добиться 50% прироста её средней продолжительности в любой стране.
В отличие от всех лекарственных подходов и прочих средств с недоказанной эффективностью, есть ряд рекомендаций, которые достоверно приводят к увеличению продолжительности жизни (по крайней мере, в среднем):
- заниматься физкультурой;
- не курить, не принимать наркотики;
- ограничить употребление алкоголя;
- правильно питаться.
- а главное, как говорится, почаще улыбайтесь!
Литература
1. Wong CH, Siah KW, Lo AW. Estimation of clinical trial success rates and related parameters. Biostat Oxf Engl. 2018 Jan 31.
2. Lidsky PV, Andino R. Protection from epidemics is a driving force for evolution of lifespan setpoints. bioRxiv [Internet]. 2017 Nov 6 [cited 2018 May 16];215202. Available from: https://www.biorxiv.org/content/early/2017/11/06/215202.
3. Arai Y, Martin-Ruiz CM, Takayama M, Abe Y, Takebayashi T, Koyasu S, Suematsu M, Hirose N, von Zglinicki T. Inflammation, But Not Telomere Length, Predicts Successful Ageing at Extreme Old Age: A Longitudinal Study of Semi-supercentenarians. EBioMedicine. 2015 Oct;2(10):1549–58.
4. Mitteldorf J. Is programmed aging a cause for optimism? Curr Aging Sci. 2015;8(1):69–75.
5. Ocampo A, Reddy P, Martinez-Redondo P, Platero-Luengo A, Hatanaka F, Hishida T, Li M, Lam D, Kurita M, Beyret E, Araoka T, Vazquez-Ferrer E, Donoso D, Roman JL, Xu J, Esteban CR, Nuñez G, Delicado EN, Campistol JM, Guillen I, Guillen P, Belmonte JCI. In Vivo Amelioration of Age-Associated Hallmarks by Partial Reprogramming. Cell [Internet]. 2016 Dec 15 [cited 2018 May 15];167(7):1719-1733.e12. Available from: https://www.cell.com/cell/abstract/S0092-8674(16)31664-6.
6. Falandry C, Bonnefoy M, Freyer G, Gilson E. Biology of cancer and aging: a complex association with cellular senescence. J Clin Oncol Off J Am Soc Clin Oncol. 2014 Aug 20;32(24):2604–10.
7. Passos JF, Von Zglinicki T. Oxygen free radicals in cell senescence: are they signal transducers? Free Radic Res. 2006 Dec;40(12):1277–83.
8. Shirley R, Ord ENJ, Work LM. Oxidative Stress and the Use of Antioxidants in Stroke. Antioxidants [Internet]. 2014 Jul 3;3(3):472–501. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4665418/.
9. Li J, Bonkowski MS, Moniot S, Zhang D, Hubbard BP, Ling AJY, Rajman LA, Qin B, Lou Z, Gorbunova V, Aravind L, Steegborn C, Sinclair DA. A conserved NAD+ binding pocket that regulates protein-protein interactions during aging. Science [Internet]. 2017 Mar 24 [cited 2018 May 14];355(6331):1312–7. Available from: http://science.sciencemag.org/content/355/6331/1312.
10. Scientists unveil a giant leap for anti-aging [Internet]. ScienceDaily. [cited 2018 May 14]. Available from: https://www.sciencedaily.com/releases/2017/03/170323141340.htm.
11. Swerdlow RH. Is NADH Effective in the Treatment of Parkinson’s Disease? Drugs Aging [Internet]. 1998 Oct 1 [cited 2018 May 14];13(4):263–8. Available from: https://link.springer.com/article/10.2165/00002512-199813040-00002.
12. Barzilai N, Crandall JP, Kritchevsky SB, Espeland MA. Metformin as a Tool to Target Aging. Cell Metab [Internet]. 2016 Jun 14;23(6):1060–5. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5943638/.
13. Mannick JB, Giudice GD, Lattanzi M, Valiante NM, Praestgaard J, Huang B, Lonetto MA, Maecker HT, Kovarik J, Carson S, Glass DJ, Klickstein LB. mTOR inhibition improves immune function in the elderly. Sci Transl Med [Internet]. 2014 Dec 24 [cited 2018 May 14];6(268):268ra179-268ra179. Available from: http://stm.sciencemag.org/content/6/268/268ra179.
14. Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice | Nature Medicine [Internet]. [cited 2018 May 14]. Available from: https://www.nature.com/articles/nm.3569.
15. Abbott A. Infusions of young blood tested in patients with dementia. Nat News [Internet]. [cited 2018 May 14]; Available from: http://www.nature.com/news/infusions-of-young-blood-tested-in-patients-with-dementia-1.22930.
16. Tompkins BA, DiFede DL, Khan A, Landin AM, Schulman IH, Pujol MV, Heldman AW, Miki R, Goldschmidt-Clermont PJ, Goldstein BJ, Mushtaq M, Levis-Dusseau S, Byrnes JJ, Lowery M, Natsumeda M, Delgado C, Saltzman R, Vidro-Casiano M, Da Fonseca M, Golpanian S, Premer C, Medina A, Valasaki K, Florea V, Anderson E, El-Khorazaty J, Mendizabal A, Green G, Oliva AA, Hare JM. Allogeneic Mesenchymal Stem Cells Ameliorate Aging Frailty: A Phase II Randomized, Double-Blind, Placebo-Controlled Clinical Trial. J Gerontol Ser A [Internet]. 2017 Oct 12 [cited 2018 May 23];72(11):1513–22. Available from: https://academic.oup.com/biomedgerontology/article/72/11/1513/3977809.
17. Panés J, García-Olmo D, Van Assche G, Colombel JF, Reinisch W, Baumgart DC, Dignass A, Nachury M, Ferrante M, Kazemi-Shirazi L, Grimaud JC, de la Portilla F, Goldin E, Richard MP, Leselbaum A, Danese S, ADMIRE CD Study Group Collaborators. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet Lond Engl. 2016 Sep 24;388(10051):1281–90.
18. Wang S, Qu X, Zhao RC. Clinical applications of mesenchymal stem cells. J Hematol OncolJ Hematol Oncol [Internet]. 2012 Apr 30 [cited 2018 May 23];5:19. Available from: https://doi.org/10.1186/1756-8722-5-19.
19. Commissioner O of the. Press Announcements — Statement from FDA Commissioner Scott Gottlieb, M.D. on the FDA’s new policy steps and enforcement efforts to ensure proper oversight of stem cell therapies and regenerative medicine [Internet]. [cited 2018 May 23]. Available from: https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm573443.htm.
20. Blagosklonny MV. Aging is not programmed. Cell Cycle [Internet]. 2013 Dec 15;12(24):3736–42. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3905065/.
21. Gierman HJ, Fortney K, Roach JC, Coles NS, Li H, Glusman G, Markov GJ, Smith JD, Hood L, Coles LS, Kim SK. Whole-genome sequencing of the world’s oldest people. PloS One. 2014;9(11):e112430.
22. Sebastiani P, Riva A, Montano M, Pham P, Torkamani A, Scherba E, Benson G, Milton JN, Baldwin CT, Andersen S, Schork NJ, Steinberg MH, Perls TT. Whole genome sequences of a male and female supercentenarian, ages greater than 114 years. Front Genet. 2011;2:90.
23. Mestas J, Hughes CCW. Of Mice and Not Men: Differences between Mouse and Human Immunology. J Immunol [Internet]. 2004 Mar 1 [cited 2018 May 15];172(5):2731–8. Available from: http://www.jimmunol.org/content/172/5/2731.
24. Mitchell SJ, Scheibye-Knudsen M, Longo DL, de Cabo R. Animal models of aging research: implications for human aging and age-related diseases. Annu Rev Anim Biosci. 2015;3:283–303.
25. Denayer T, Stöhr T, Van Roy M. Animal models in translational medicine: Validation and prediction. New Horiz Transl Med [Internet]. 2014 Sep 1;2(1):5–11. Available from: http://www.sciencedirect.com/science/article/pii/S2307502314000022.
26. Worp HB van der, Howells DW, Sena ES, Porritt MJ, Rewell S, O’Collins V, Macleod MR. Can Animal Models of Disease Reliably Inform Human Studies? PLOS Med [Internet]. 2010 Mar 30 [cited 2018 May 15];7(3):e1000245. Available from: http://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1000245.
27. Xia X, Chen W, McDermott J, Han J-DJ. Molecular and phenotypic biomarkers of aging. F1000Research [Internet]. 2017 Jun 9;6. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5473407/.
28. Li Y, Pan A, Wang DD, Liu X, Dhana K, Franco OH, Kaptoge S, Angelantonio ED, Stampfer M, Willett WC, Hu FB. Impact of Healthy Lifestyle Factors on Life Expectancies in the US Population. Circulation [Internet]. 2018 Apr 30 [cited 2018 May 15]; CIRCULATIONAHA.117.032047. Available from: http://circ.ahajournals.org/content/early/2018/04/25/CIRCULATIONAHA.117.032047.
Источник: brights-russia.org
Иллюстрации Анастасии Икусовой. За помощь с корректурой текста спасибо Валерии Антоновой.
Читайте на Зожнике:
Как быстро мои результаты будут ухудшаться с возрастом?
Тренировки и старение: существует ли в занятиях спортом накопительный эффект?
Могут ли физические упражнения замедлить старение ДНК?
Как уход за зубами может предотвратить заболевания сердца и старение лица
Диеты приводят к стрессу, вызывают старение и ухудшают настроение






