Теория миоядерной мышечной памяти: легче ли накачаться, если раньше был большой объем?
Пауэрлифтер и ученый-любитель Грег Наколс сделал разбор обзора исследований, посвященных изучению феномена мышечной памяти.
Другие переводы грандиозных материалов Грега Наколса в Зожнике:
- Взаимосвязь объема и силы мышц: почему некоторые больше, а некоторые — сильнее
- Влияние частоты тренировок на развитие силы,
- Чем женская тренировка должна отличаться от мужской?,
- Наука: кардио-тренировки важны для повышения результатов в силовых,
- Наука против лени: как распознать и преодолеть,
- Женщины набирают силу и массу не хуже мужчин: анализ исследований
Мышечные волокна — очень крупные клетки, которые имеют несколько ядер (в отличие от обычных клеточек, имеющих по одному ядрышку), называемых миоядрами. Каждое миоядро может «контролировать» определенный объем саркоплазмы («наполнителя» мышечных волокон); саркоплазма, контролируемая конкретным миоядром, называется «миоядерным доменом». По мере того, как волокна становятся больше, а миоядерные домены достигают предельного объема, мышечные волокна берут новые миоядра из клеток-сателлитов, чтобы продолжать расти. Все это обычно называют «теорией миоядерного домена».
Итак, при гипертрофии в мышечных волокнах появляется больше миоядер, но исчезают ли они при атрофии? В прорывном исследовании 2013 года обнаружилось, что мыши накапливали больше миоядер при наборе мышц, когда им давали тестостерон [2]. Когда же тестостероновая терапия закончилась, мыши теряли в объемах, но сохраняли накопленные миоядра. Потом, получая нагрузку, эти подопытные быстрее набирали мышцы, чем мыши контрольной группы, у которых не было повышенного числа миоядер.
Это открытие (в дополнение к ряду других исследований на животных) привело людей к теории, что миоядра не теряются при прекращении тренировок и атрофии мышц, повышается миоядерная плотность, а это позволяет быстрее вновь набирать мышцы. У каждого миоядра конечная «транскрипционная способность» (количество белка, которое производят рибосомы), поэтому более высокая миоядерная плотность после прекращения тренировок позволяет мышечной ткани восстанавливаться быстрее, чем при первоначальном наборе.
Считается, что этот механизм лежит в основе феномена «мышечной памяти» — быстром восстановлении мышц при возобновлении тренировок.
Полагаю, многие видели известную схему (Рисунок 1), иллюстрирующую эту концепцию [3].
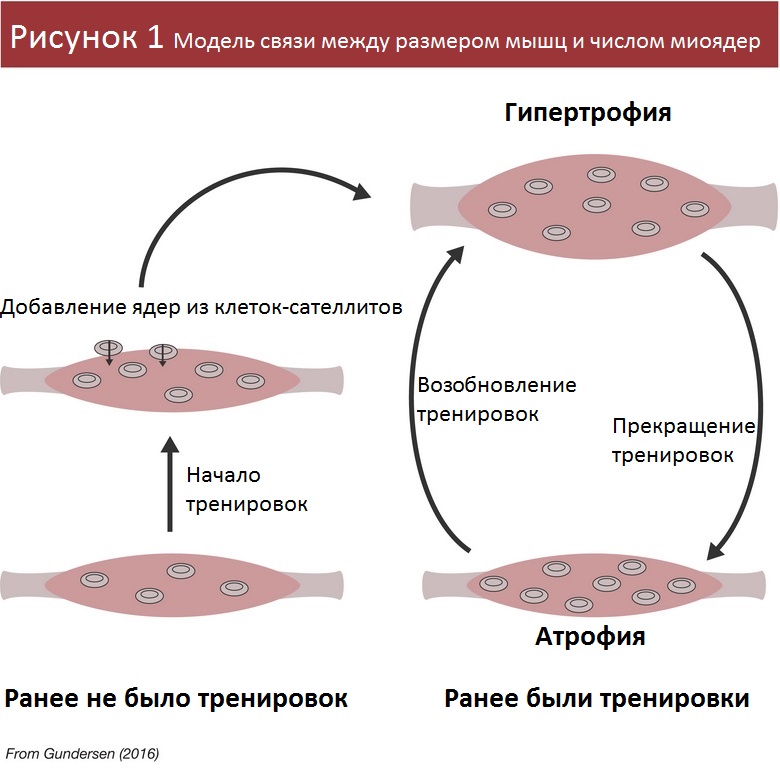
Выглядит теория, конечно, неплохо, но насколько она подтверждается результатами исследований? Похоже, мы слишком рано обрадовались.
Авторы рассматриваемого мной обзора [1] проанализировали большое количество исследований, и оказалось, что подтвердить концепцию не особо удается.
Цель обзора
Цель данного обзора — «выявить любые подтверждения или опровержения выдвинутой теории «мышечной памяти» при атрофии и гипертрофии мышечных волокон как в исследованиях на животных, так и с участием людей».
Испытуемые и методика
“Испытуемыми” в данном обзоре были результаты ранее проведенных исследований: 60 работ с участием животных и 16 с участием людей.
Дизайн исследования
Данный обзор не был систематическим, то есть не существовало заранее определенной стратегии поиска, а также критериев отбора работ. Я не считаю это существенным недостатком, поскольку область мало исследовалась, и авторы, безусловно, знакомы с ней значительно лучше, чем я. В любом случае я не находил примечательных исследований, которые не были бы включены в этот обзор [1], и считаю его систематическим (не по формальным признакам, но по сути).
Обзор начинается с объяснения методов исследования, используемых для изучения миоядерной теории, а также плюсов и минусов этих методов. Затем рассказывается, как мы пришли к нашей сегодняшней концепции миоядерной мышечной памяти. Наконец, в нем обобщаются научные данные, подтверждающие и опровергающие теорию миоядерной мышечной памяти, из всех экспериментов на животных и людях.
Методика исследования
Поскольку я делаю разбор не для специалистов в области мышечной физиологии, то не буду углубляться во все клеточные подробности. Стоит, однако, отметить одну значительную проблему, связанную с изучением миоядер: необходимо отделять миоядра от ядер иных клеток (например, ядер клеток-спутников). Для этого используются две прогрессивные методики. При первой мышечные волокна помечают красителями, которые позволяют различать миоядра, границы клеток и клетки-сателлиты. При второй миоядра маркируются флуоресцентным зеленым белком и наблюдаются определенное время в живом организме in vivo (т.е. без удаления ткани). Оба метода относительно новые, потому применены в небольшом числе исследований этой области.
История
Я узнал об исследованиях миоядер только после того, как концепция миоядерной мышечной памяти стала уже достаточно популярной. Работы, в значительной степени повлиявшие на это, были опубликованы в 2012 и 2013 годах [2, 4].
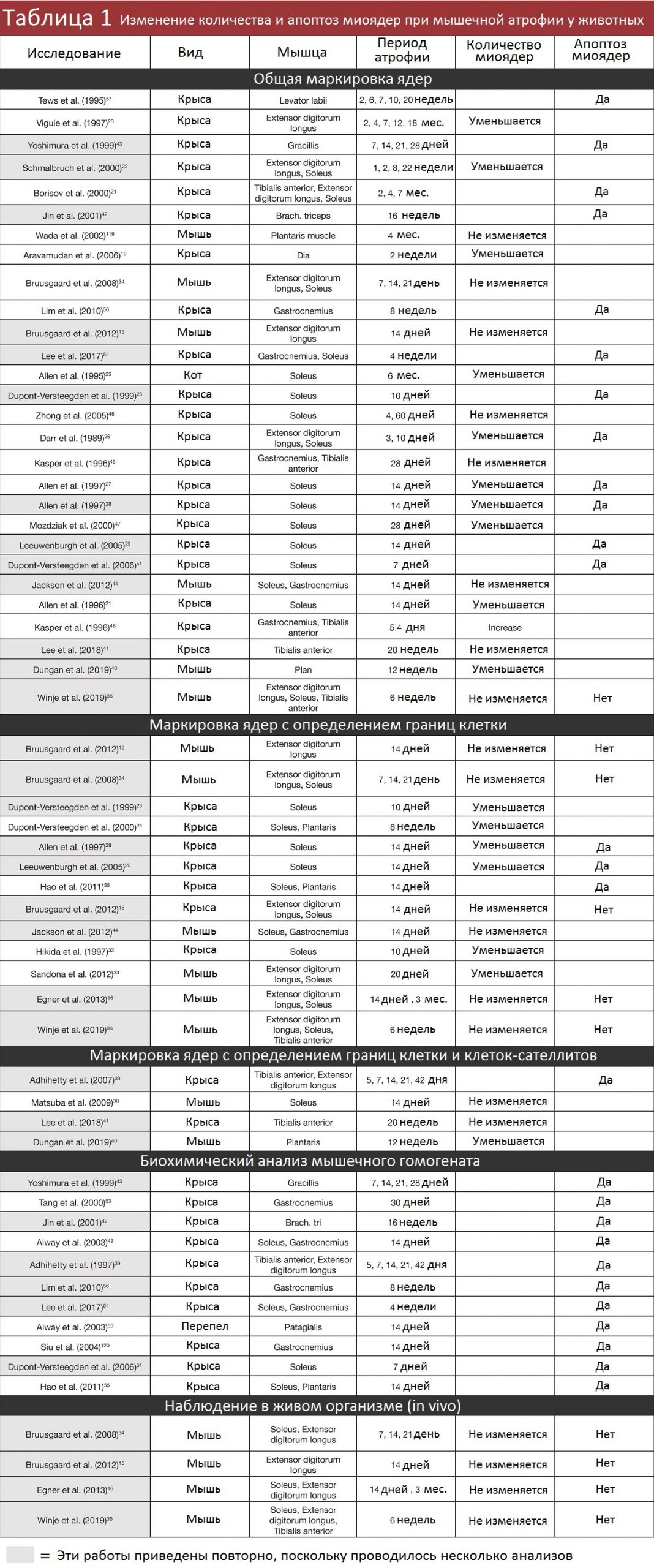
До того считалось, что мышечные волокна приобретают миоядра при гипертрофии и теряют при атрофии. И на самом деле, были веские основания полагать, что так оно и есть. Во многих исследованиях были обнаружены свидетельства апоптоза (смерти) ядер при атрофии, и в значительной доле ранних работ отмечалось, что общее число ядер при анализе мышечного сечения сокращалось по мере уменьшения размеров мышечных волокон (обобщенные данные приведены в Таблице 1).
Однако в прорывных исследованиях 2012 и 2013 гг. использовался упомянутый выше метод наблюдения живого организма, который четко разграничивает миоядра и ядра других клеток в этой области. Их авторы утверждали, что в предыдущих работах просто наблюдалась потеря других ядер (ядер клеток-сателлитов и стромальных клеток), а не миоядер.
После публикации этих фундаментальных исследований концепция начала меняться — миоядра накапливаются, когда растут мышечные волокна, но не теряются, когда волокна атрофируются. Таким образом, в этой интерпретации миоядра, которые вы накапливаете, сохраняются и обеспечивают более быстрый мышечный рост при возобновлении тренировок.
Исследования на животных
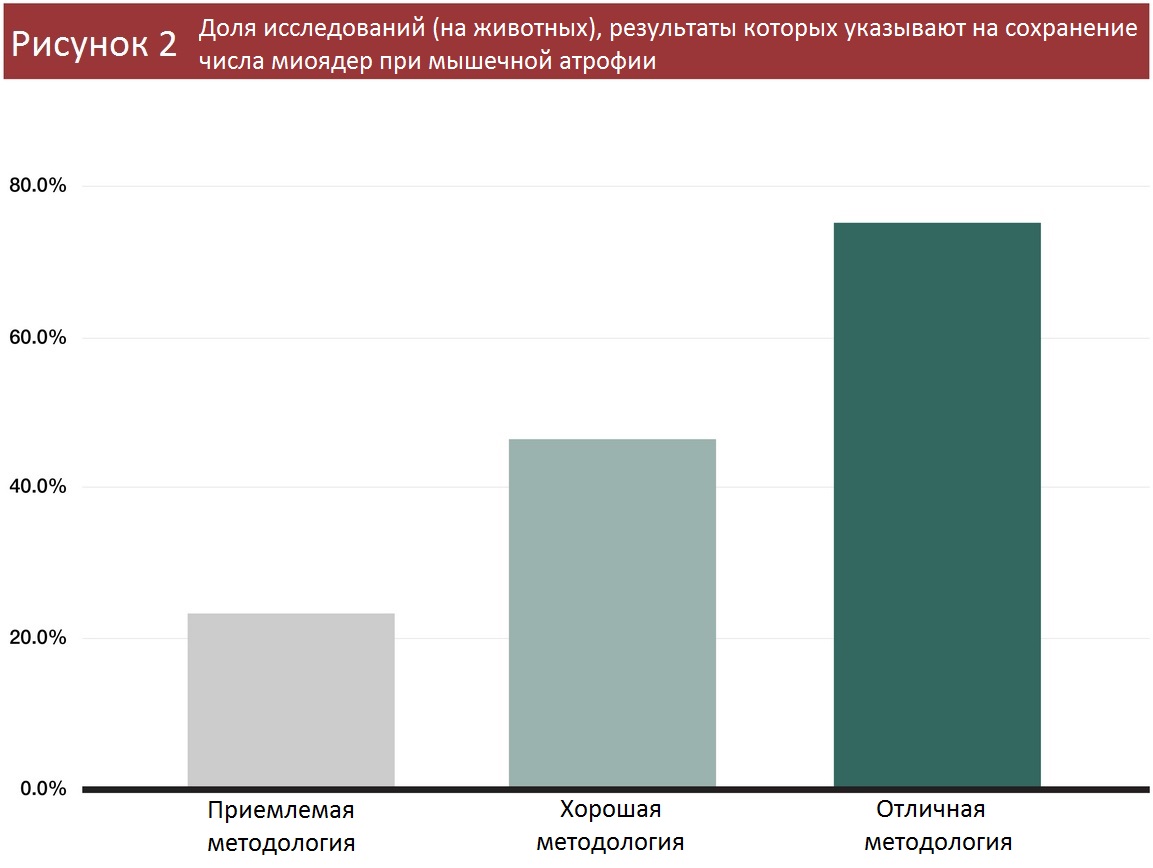
За исключением одного эксперимента с перепелками и одного с кошками, все исследования миоядер проводились на мышах и крысах. В 39 из 60 работ методология была устаревшей — сложности с разграничением миоядер и ядер других клеток в исследуемой области. В 30 исследованиях из этих 39 обнаружилось, что число ядер уменьшалось при мышечной атрофии. И 34 из этих 39 исследований были проведены до 2013 года, когда ученые еще не узнали, насколько недостоверны их методы.
Еще в 13 работах методология была получше, но тоже не идеальна, поскольку окрашивались ядра и внутри волокон (миоядра), и снаружи (не миоядра). Эти 13 исследований разделились почти пополам: в семи насчитали сокращение миоядер при мышечной атрофии, а в шести – остались на месте.
Зато в оставшихся восьми работах наконец-то применяли современный гистологический подход (окрашивание миоядер) или наблюдали миоядра в живом организме. Из четырех исследований, где применялся гистологический метод, в двух заметили сокращение числа миоядер, а в двух – не заметили изменений. И ни в одном из четырех прогрессивных экспериментах, где процесс наблюдали в естественных условиях, не выявлена пропажа миоядер.
Таким образом, по мере совершенствования методологии все чаще не удается обнаружить сокращение числа миоядер при атрофии. И все же в некоторых экспериментах (даже при использовании высококачественной методики) отмечается потеря миоядер, хотя есть мнение, что они исчезают не с той же скоростью, с которой происходит атрофия.
Перекрестные исследования с участием людей
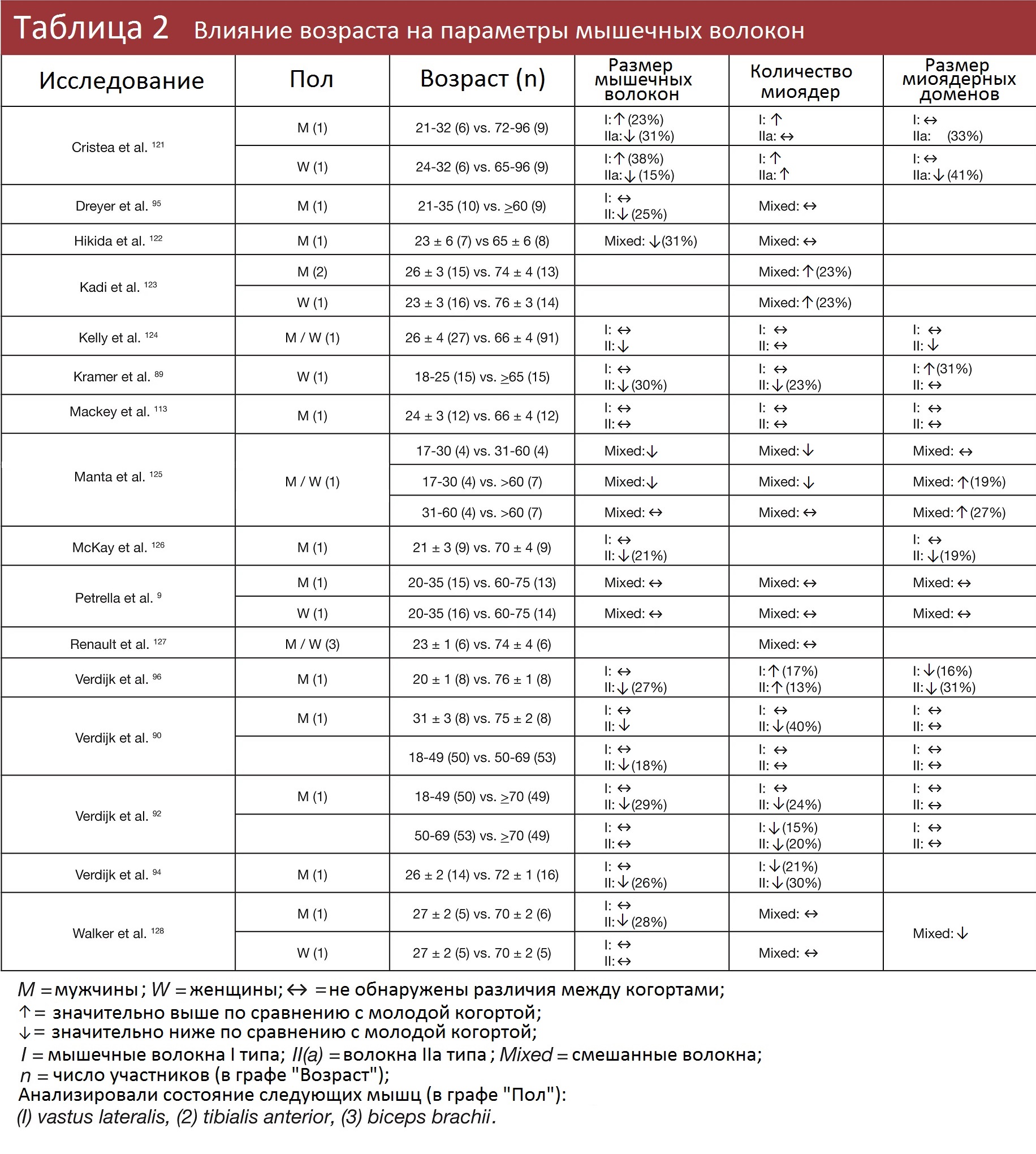
В большинстве работ применялся перекрестный анализ: вместо того, чтоб истязать подопытных умышленной атрофией, исследователи сравнивают размер мышечных волокон, количество миоядер и размер миоядерных доменов между молодыми и пожилыми людьми.
У пожилых людей (60+) мышечные волокна, как правило, меньше, чем у более молодых, особенно это касается волокон II типа. Если в ходе исследования установлено, что у пожилых людей волокна меньше, но содержание миоядер и миоядерных доменов примерно одинаково, это говорит о том, что после возрастной мышечной атрофии миоядра не теряются.
Результаты противоречивые. Я опускаю выводы, связанные с изучением волокон I типа (в большинстве случаев у молодых и пожилых людей ситуация схожа); из тех групп, где рассматривались волокна II типа, в четырех обнаружено уменьшение миоядерных доменов у пожилых, а в семи — у молодых и пожилых участников миоядерные домены схожих размеров.
Из исследований, где мышечные волокна не разделяли по типу (I и II вместе), в пяти обнаружили уменьшение миоядерных доменов у пожилых, в четырех — миоядерные домены одинаковы по размерам, а еще в двух даже оказалось, что у пожилых миоядерные домены больше.
В целом картина та же, что и с другими животными.
В 9 случаях из 22 миоядра либо сохраняются, либо теряются, но медленнее, чем происходит атрофия волокон.
В 11 работах выводят, что атрофия волокон и потеря миоядер происходят в одном темпе, а в 2 предполагают, что миоядра исчезают быстрее.
Напомню, что это перекрестный анализ, то есть нельзя вывести причинно-следственную связь, а также нельзя утверждать, что возрастная атрофия оказывает точно такое же воздействие на миоядра, как и мышечная атрофия в результате прекращения тренировок.
Долгосрочные исследования с участием людей
В обзоре есть также 4 лонгитюдных исследования, которые стоит упомянуть.
Как я уже говорил, ценные данные о миоядерной мышечной памяти удалось получить в исследовании 2013 года [2]. Ученые вводили мышам тестостерон, который вызывал как рост мышц, так и увеличение числа миоядер. Затем мышек снимали с курса, и они теряли мышцы, однако — несмотря на атрофию – число миоядер оставалось повышенным. Затем этих мышей и контрольную группу прокачивали негуманным способом (перерезанием синергистов). В итоге группа бывших «химиков» набрала вдвое больше массы, чем натуралы (не имевшие повышенного объема миоядер).
Недавно группа ученых попыталась повторить этот эксперимент на людях [5], только вместо инъекций тестостерона были банальные тренировки. Подопытные сперва 10 недель качали одну ногу, затем 20 недель отдыха, а потом проработка обеих ног в течение 5 недель.
С этим исследованием, правда, есть пара базовых проблем:
1. хотя мышечные волокна тренируемой ноги росли в течение первых 10 недель, испытуемые не успели накопить много миоядер,
2. за 20 недель отдыха волокна не атрофировались до исходного размера.
Так что «мышиного» эффекта добиться не удалось.
Другой эксперимент продлился чуть дольше и порадовал чуть больше [6]: участники тренировались 6 месяцев и отдыхали потом год. Саму мышечную память проверить не получилось (тренировки не возобновлялись), но участники набрали больше миоядер в период гипертрофии, а за год постепенно растеряли и мышечную массу, и миоядра.
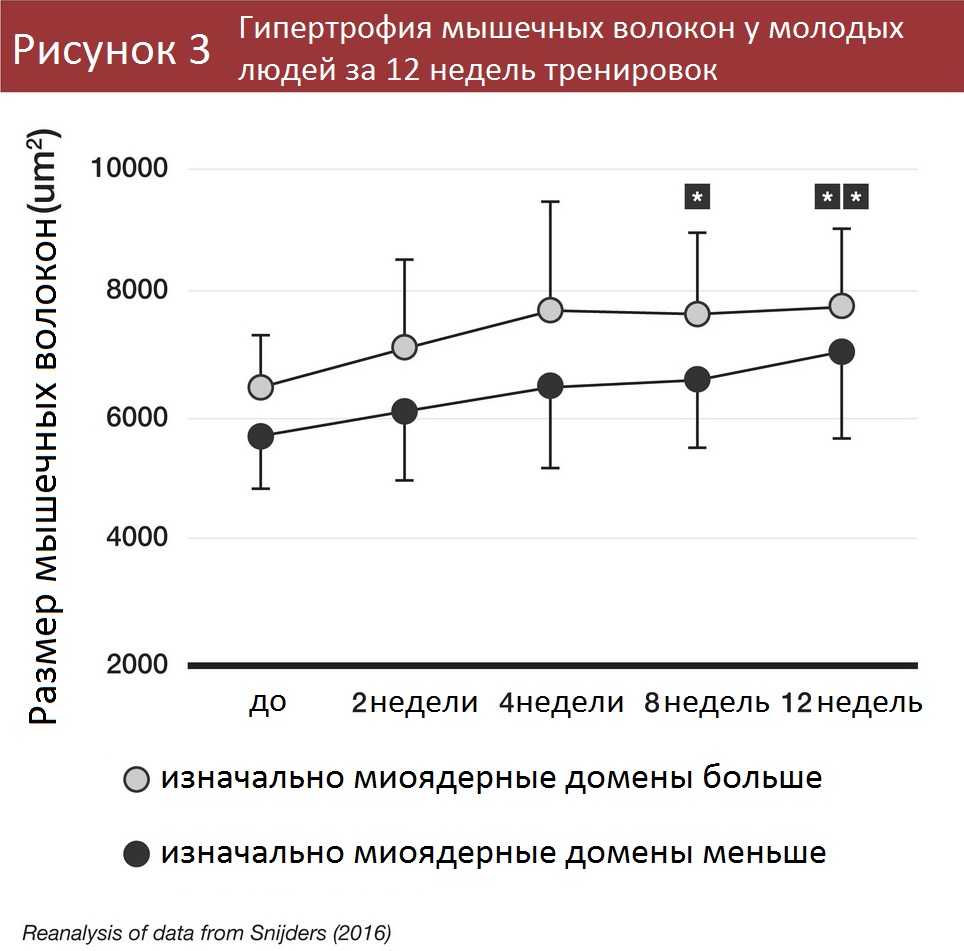
Пара оставшихся работ все же прибавила материала по миоядерной мышечной памяти. В одном исследовании молодые люди с меньшими размерами миоядерных доменов наращивали мышечную массу медленнее, чем те, у кого миоядерные домены изначально были больше [7].
Участники с большими миоядерными доменами просто накапливали новые миоядра быстрее и также быстрее увеличивали мышцы.
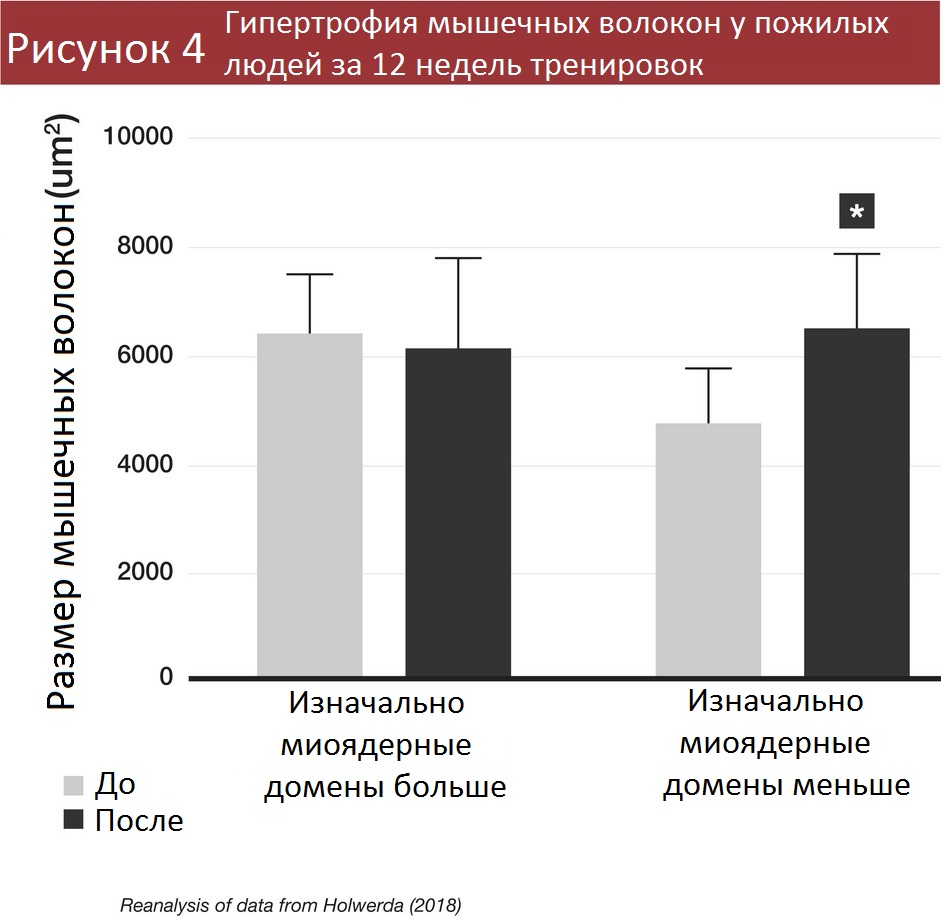
Результаты другого эксперимента с участием пожилых людей [8], правда, были противоположными: участники с меньшими миоядерными доменами смогли добиться значительной гипертрофии при тренировках, а участники с большими миоядерными доменами – нет.
Интерпретация
Напомню, мы разбираемся не с мышечной памятью вообще, а исследуем влияние на нее миоядер. Феномен «мышечной памяти» – когда восстановление мышц происходит быстрее, чем первоначальный набор – научно задокументирован еще в начале 90-х годов прошлого века [9], и его существование подтверждают как научные данные [10], так и устные свидетельства тысяч качков. Пара главных вопросов: 1. сохраняются ли набранные миоядра после атрофии мышц? 2. это ли основной механизм, объясняющий феномен «памяти мышц»?
И по обоим пунктам не все так однозначно. Хотя во всех исследованиях на живых животных (in vivo) миоядра сохранялись после атрофии, при применении второго достоверного метода изучения (маркировка миоядер, клеточных мембран и клеток-сателлитов) в половине экспериментов все же замечали потерю миоядер. И больше половины результатов перекрестных исследований на людях также демонстрируют потерю миоядер вследствие возрастной атрофии. Таким образом, хотя бы часть миоядер пропадает при значительной мышечной атрофии.
Однако, «миоядра могут теряться во время или после атрофии» не означает, что «миоядра теряются с той же скоростью, с какой происходит атрофия волокон». Я думаю, что объяснить противоречивые, казалось бы, результаты можно одним из двух способов (или их комбинацией):
- Миоядра теряются при атрофии, но этот процесс существенно «отстает» от самой атрофии.
- Миоядра теряются при атрофии, но не у молодых людей, а у пожилых.
Разберем первое потенциальное объяснение. Допустим, после 6 месяцев без тренировок мышечные волокна уменьшаются в размере на 20%. Миоядра при этом могут еще удерживаться в течение нескольких месяцев, а то и лет. Просто уменьшается размер миоядерных доменов.
После года без тренировок, возможно, число миоядер сокращается на 10%, а через два — на 20%, что соответствует потере общего размера волокна. При такой модели миоядра хоть и не сохраняются навсегда, но все же могли бы несколько помочь с «мышечной памятью». Поясню: я не утверждаю, что миоядра держатся года два, это условный период, чтобы описать идею.
Второй вариант проще – миоядра с большей вероятностью потеряются по мере старения организма. Например, вы упорно тренируетесь в школе и колледже, набираете много мышц, накапливаете много миоядер, а потом устраиваетесь на работу и забрасываете тренировки лет на 10. Мышечная масса уходит, но миоядра держатся из последних сил. Если в 30 лет возобновляете тренировки, то быстрее наберете прежнюю массу. Однако, если так ничего и не делать, вы можете начать терять эти миоядра лет в 50 лет, и к 70 их останется столько, сколько было изначально (как у человека, который вообще никогда не качался). Опять же, оговорюсь, эти сроки условны.
А теперь совместим оба предположения: вы тренируетесь в школе и колледже, набираете много мышц, накапливаете много миоядер, а потом бросаете железо. В течение следующего десятилетия можете терять миоядра, но процесс идет медленно. Если вы повысили содержание миоядер на 20% за тренировочный период, то, вероятно, при десятилетнем отдыхе еще удержите процентов 10 – пока вам 20-30 лет. Но если вы прекратили тренироваться в 70 лет, то миоядра могут улетать гораздо быстрее. Например, за 6 месяцев растеряли набранные объемы, а за год – и новые миоядра.
Не знаю, какой из трех вариантов (первый, второй или комбо) наиболее близок к реальности, но думаю, что все три лучше, чем упрощенный взгляд – миоядра остаются навсегда или их апоптоз происходит в том же темпе, что и атрофия мышечных волокон.
Следующий вопрос: «Если эти миоядра и задерживаются на довольно долгое время, имеет ли это значение?» Как вы помните, одно из оснований концепции миоядерной мышечной памяти заключается в том, что большая миоядерная плотность (меньшие миоядерные домены) повышает транскрипционную способность, то есть позволяет производить больше мышечных белков после тренировочного стимула. И про это есть пара исследований [7, 8].
В исследовании с участием молодых людей обнаружилось, что испытуемые с изначально меньшими миоядерными доменами не наращивали мышцы быстрее [7], а вот пожилые с меньшими миоядерными доменами накачивались быстрее [8]. Разница результатов, видимо, связана со способностью испытуемых накапливать больше миоядер. У молодых людей с крупными миоядерными доменами накапливалось и больше миоядер, потому они и увеличивали мышцы лучше. Пожилым же было сложнее получать новые миоядра, потому малые миоядерные домены сработали эффективнее.
Эта часть миоядерной теории мышечной памяти, на мой взгляд, имеет некоторый смысл:
— если ваши мышцы атрофируются, но вы сохраняете миоядра, то увеличение транскрипционной способности может в какой-то степени ускорить повторный набор мышц. Однако, если добавить еще одну переменную — способность легче накапливать миоядра (как было замечено в исследовании на молодых испытуемых) – уже не кажется, что размер миоядерных доменов так важен.
Таким образом, приписываемый миоядрам эффект «мышечной памяти» может быть весьма незначительным для большинства людей. Его значение выше для людей, которым труднее накапливать больше миоядер (пожилым и тем, кто вообще с трудом набирает мышечную массу). Если же вы относительно молоды и ранее преуспевали в бодибилдинге, то наличие большего количества миоядер, сохранившихся при атрофии, может и не играть существенной роли в том эффекте «мышечной памяти», который вы наблюдаете при возобновлении тренировок.
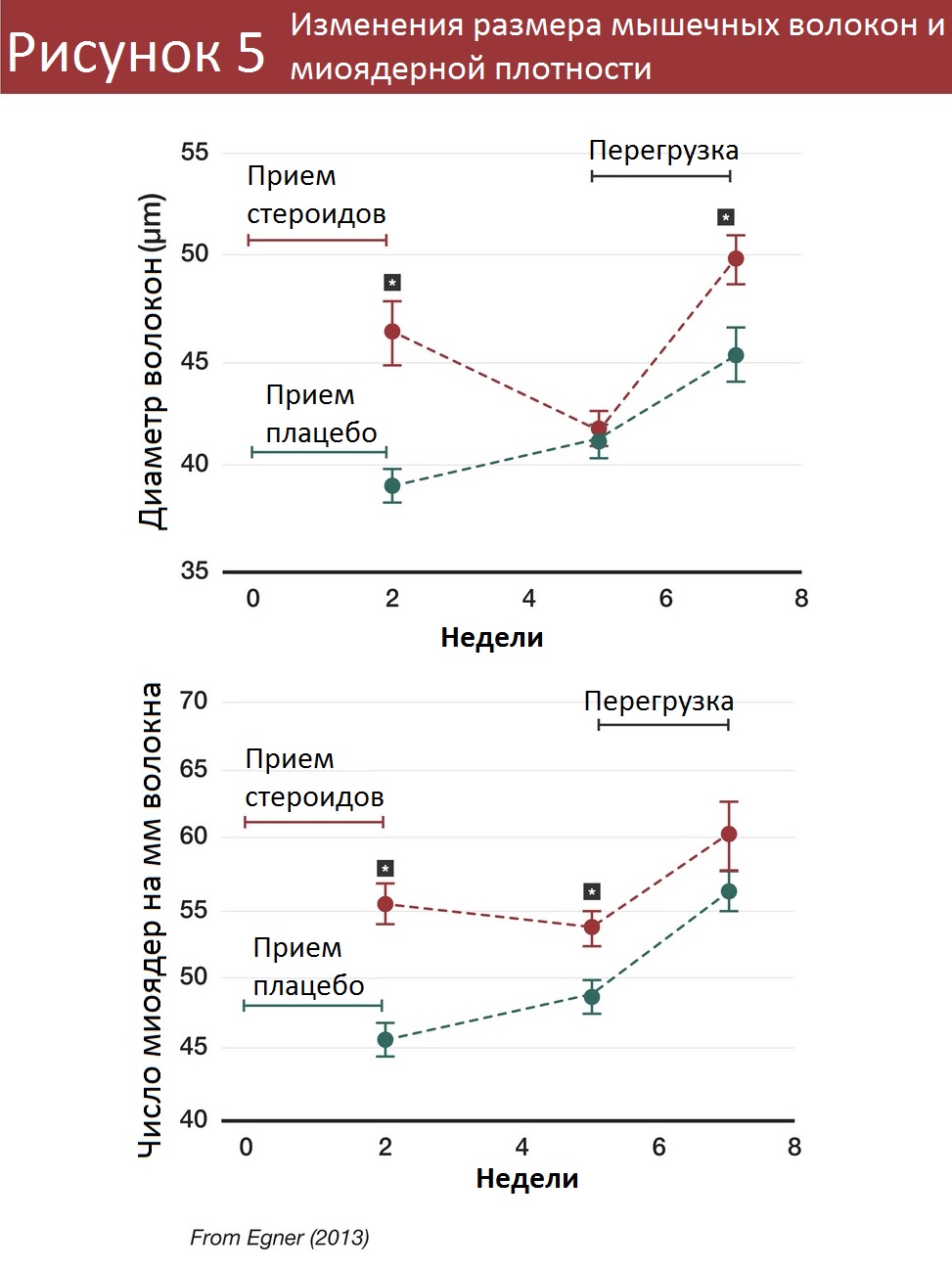
Если как следует изучить фундаментальное исследование Эгнера [2], где демонстрировалась мышечная память у мышей, становится понятно, что миоядра, скорее всего, не могут полностью объяснить этот феномен. После 3 недель мышечной атрофии в группе мышей, которые ранее получали тестостерон, их мышечные волокна были того же размера, что и у мышей, которые получали пустышку, а миоядерная плотность (количество миоядер на мм длины волокна) была выше примерно на 15%.
После 2 недель перегрузки мыши, ранее получавшие тестостерон, набрали примерно вдвое больше мышц. Грубо говоря, если дополнительные 15% миоядер повышали транскрипционную способность на 15%, то как объяснить 100% разницы в результате? Какой-то иной механизм должен обеспечить оставшиеся 85%.
И все же, я думаю, есть пара случаев, когда сохранение миоядер после атрофии может иметь значение.
Первый — старение. Поскольку пожилым людям сложнее накапливать новые миоядра, то, имея тренировочный опыт в прошлом, они могут лучше набирать мышечную массу. Это еще одна польза, о которой следует говорить для популяризации железа.
Второй – спорт. Если стероиды позволяют накапливать больше миоядер, то «химики» могут иметь долгосрочное преимущество перед чистыми спортсменами, которые никогда не использовали допинг. Если эти «химические» миоядра останутся, скажем, на 10 лет (или дольше), то нынешние допинговые запреты WADA (2 года за первое нарушение) выглядят слегка неадекватными. Надо б начать обсуждать пожизненный запрет.
Итак, если миоядерная теория не может полностью объяснить феномен мышечной памяти, каковы другие возможные механизмы?
Один из главных претендентов — эпигенетическая модификация [10]. Мышечная ткань крайне пластична, то есть способна быстро изменяться и адаптироваться (хотя бы по сравнению с большинством других тканей), но механизмы мышечной памяти должны включать изменения, которые сохраняются в течение месяцев, если не лет.
Белки регулярно заменяются, плотность митохондрий быстро уменьшается после прекращения тренировок, капилляризация уменьшается в течение нескольких недель и т.д. Дело, возможно, в рибосомной плотности: она может быть связана с гипертрофией (11), а я пока ничего не могу сказать о том, как быстро снижается рибосомная плотность после прекращения тренировок.
Или же “виновником” может быть некий нейронный механизм: мы сохраняем двигательные навыки во время перерыва, что позволяет нам быстрее добраться до определенных рабочих весов, чем человеку, который приступает к тренировкам впервые.
Заключение
Роль миоядер — когда мы говорим о мышечной памяти — туманна. Похоже, что они уходят медленнее, чем атрофируются мышечные волокна, но все же не остаются с нами на всю жизнь. И хотя миоядра могут играть свою роль, «мышечная память», по-видимому, в большей степени обеспечивается иными механизмами.
Упомянутые научные исследования:
1. Snijders T, Aussieker T, Holwerda A, Parise G, van Loon LJC, Verdijk LB. The concept of skeletal muscle memory: Evidence from animal and human studies. Acta Physiol (Oxf). 2020;229(3):e13465. doi:10.1111/apha.13465
2. Egner IM, Bruusgaard JC, Eftestøl E, Gundersen K. A cellular memory mechanism aids overload hypertrophy in muscle long after an episodic exposure to anabolic steroids. J Physiol. 2013;591(24):6221-6230. doi:10.1113/jphysiol.2013.264457
3. Gundersen K. Muscle memory and a new cellular model for muscle atrophy and hypertrophy. J Exp Biol. 2016;219(Pt 2):235-242. doi:10.1242/jeb.124495
4. Bruusgaard JC, Egner IM, Larsen TK, Dupre-Aucouturier S, Desplanches D, Gundersen K. No change in myonuclear number during muscle unloading and reloading. J Appl Physiol (1985). 2012;113(2):290-296. doi:10.1152/japplphysiol.00436.2012
5. Psilander N, Eftestøl E, Cumming KT, et al. Effects of training, detraining, and retraining on strength, hypertrophy, and myonuclear number in human skeletal muscle. J Appl Physiol (1985). 2019;126(6):1636-1645. doi:10.1152/japplphysiol.00917.2018
6. Snijders T, Leenders M, de Groot LCPGM, van Loon LJC, Verdijk LB. Muscle mass and strength gains following 6 months of resistance type exercise training are only partly preserved within one year with autonomous exercise continuation in older adults. Exp Gerontol. 2019;121:71-78. doi:10.1016/j.exger.2019.04.002
7. Snijders T, Smeets JS, van Kranenburg J, Kies AK, van Loon LJ, Verdijk LB. Changes in myonuclear domain size do not precede muscle hypertrophy during prolonged resistance-type exercise training. Acta Physiol (Oxf). 2016;216(2):231-239. doi:10.1111/apha.12609
8. Holwerda AM, Overkamp M, Paulussen KJM, et al. Protein Supplementation after Exercise and before Sleep Does Not Further Augment Muscle Mass and Strength Gains during Resistance Exercise Training in Active Older Men. J Nutr. 2018;148(11):1723-1732. doi:10.1093/jn/nxy169
9. Staron RS, Leonardi MJ, Karapondo DL, et al. Strength and skeletal muscle adaptations in heavy-resistance-trained women after detraining and retraining. J Appl Physiol (1985). 1991;70(2):631-640. doi:10.1152/jappl.1991.70.2.631
10. Seaborne RA, Strauss J, Cocks M, et al. Human Skeletal Muscle Possesses an Epigenetic Memory of Hypertrophy. Sci Rep. 2018;8(1):1898. Published 2018 Jan 30. doi:10.1038/s41598-018-20287-3
11. Roberts MD, Haun CT, Mobley CB, et al. Physiological Differences Between Low Versus High Skeletal Muscle Hypertrophic Responders to Resistance Exercise Training: Current Perspectives and Future Research Directions. Front Physiol. 2018;9:834. Published 2018 Jul 4. doi:10.3389/fphys.2018.00834
Оригинал текста: Stronger by Science
Перевод для Зожника: Алексей Republicommando






