Мы уже можем изменить свою ДНК, но давайте делать это с умом
Дженнифер Дудна — известная ученая из США, труды которой в основном посвящены структурной биологии и биохимии. Дженнифер лауреатка многих престижных премий, в 1985 году получила степень бакалавра, а уже в 89 году стала доктором философии в Гарвардском университете. С 2002 года работает в Калифорнийском университете в Беркли. Широкую известность получила как исследователь РНК-интерференции и CRISPR. Исследования по Cas9 проводила вместе с Эммануэль Шарпантье.
00:12
Несколько лет назад мы с моей коллегой Эммануэль Шарпентье изобрели новую технологию редактирования геномов. Она называется CRISPR-Cas9. Технология CRISPR позволяет учёным вносить изменения в ДНК внутри клеток, что может дать нам возможность вылечивать генетические заболевания.
00:31
Возможно, вам будет интересно узнать, что технология CRISPR возникла в рамках проекта фундаментальных исследований, целью которого было выяснение того, как бактерии борются с вирусными инфекциями. Бактериям приходится сталкиваться с вирусами в среде своего обитания, и вирусную инфекцию можно представить как тикающую бомбу замедленного действия: у бактерии есть всего несколько минут, чтобы её обезвредить до того как бактерия будет разрушена. В клетках многих бактерий существует адаптивная иммунная система — CRISPR, позволяющая им выявлять и разрушать вирусную ДНК.
01:04
В состав системы CRISPR входит белок Cas9, который способен искать, расщеплять и в конечном итоге уничтожать вирусную ДНК особым способом. И именно в ходе нашего исследования по изучению активности этого белка, Cas9, мы поняли, что можем использовать его активность в генно-инженерной технологии, которая позволит учёным удалять и вставлять фрагменты ДНК внутрь клеток с невероятной точностью, что позволило бы делать то, что ранее было просто невозможно.
01:42
Технология CRISPR уже используется для изменения ДНК в клетках мышей и обезьян, а также других организмов. Недавно китайские учёные показали, что им удалось использовать технологию CRISPR даже для изменения генов эмбрионов человека. Учёные из Филадельфии показали возможность применения CRISPR для удаления ДНК интегрировавшегося вируса ВИЧ из инфицированных клеток человека.
02:09
Возможность осуществлять редактирование генома таким образом также вызывает различные этические вопросы, которые следует иметь в виду, потому что технологию можно применять не только к клеткам взрослых, но также и к эмбрионам разных организмов, в том числе и нашего вида. Таким образом, вместе с коллегами мы начали международное обсуждение изобретённой нами технологии, чтобы иметь возможность учесть все этические и общественные проблемы, связанные с подобными технологиями.
02:39
А сейчас я хочу рассказать вам, что такое технология CRISPR, что она позволяет делать, на каком мы сейчас этапе и почему я считаю, что нам нужно с осторожностью продвигаться вперёд по пути применения этой технологии.
02:54
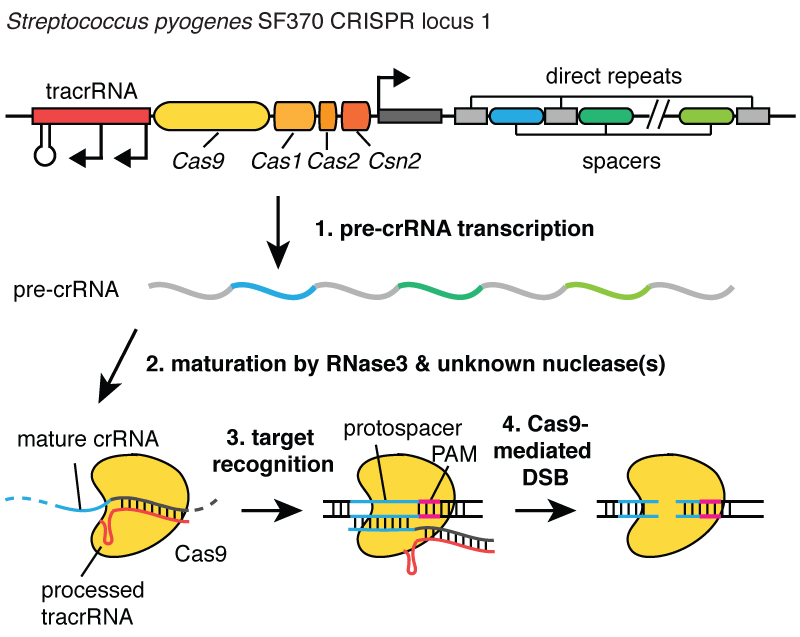
Когда вирусы инфицируют клетку, они впрыскивают свою ДНК. И внутри бактерии система CRISPR позволяет выдернуть эту ДНК из вируса и вставить её маленькие фрагменты в хромосому — в ДНК бактерии. И эти фрагменты вирусной ДНК вставляются в область, называемую CRISPR. CRISPR означает «короткие палиндромные повторы, регулярно расположенные группами». (Смех)
03:24
Длинновато. Теперь вы понимаете, почему мы используем акроним CRISPR. Это механизм, позволяющий клеткам регистрировать с течением времени вирусы, которые их заражали. И важно отметить, что эти фрагменты ДНК передаются потомкам клеток, так что клетки защищены от вирусов не в течение одного поколения, а в течение многих поколений клеток. Это позволяет клеткам сохранять «записи» об инфекции, и как говорит мой коллега Блейк Виденхефт, локус CRISPR — это фактически карточка генетической вакцинации клеток. После встраивания этих фрагментов ДНК в бактериальную хромосому клетка делает маленькую копию в виде молекулы, называемой РНК, на этом рисунке она оранжевая, и это точный отпечаток вирусной ДНК. РНК — химическая «кузина» ДНК, что позволяет ей взаимодействовать с молекулами ДНК, имеющими подходящую для неё последовательность.
04:24
Итак, эти маленькие фрагменты РНК, образованные с локуса CRISPR, ассоциируют, связываются с белком под названием Cas9, на этом рисунке он белый, и образуется комплекс, который выполняет в клетке функции часового. Он просматривает всю ДНК в клетке, чтобы найти участки, соответствующие последовательностям связанных с ним РНК. И когда эти участки найдены, как можно видеть на рисунке, где ДНК — это синяя молекула, этот комплекс связывается с этой ДНК и даёт белку Cas9 разрезать вирусную ДНК. Он очень точно вносит разрыв. Мы можем рассматривать этого часового, комплекс белка Cas9 и РНК, как пару ножниц, которые могут разрезать ДНК, — он делает двуцепочечный разрыв в спирали ДНК. И важно, что этот комплекс можно запрограммировать, например, можно его запрограммировать узнавать нужные последовательности ДНК и разрезать ДНК в на этом участке.
05:26
Как я собираюсь вам рассказать, мы поняли, что эту активность можно использовать в генной инженерии, чтобы позволить клеткам вносить очень точные изменения в ДНК на участке, где был сделан данный разрез. Это примерно как использование программы, обрабатывающей слова, для исправления опечаток в документе.
05:48
Мы смогли предположить, что систему CRISPR можно использовать в геномной инженерии, поскольку клетки способны находить разорванную ДНК и восстанавливать её. Итак, когда клетка растения или животного находит двуцепочечный разрыв в своей ДНК, она способна его устранить, либо соединяя разорванные концы ДНК, внося незначительное изменение в последовательность в этом месте, либо она может устранить разрыв, вставив новый участок ДНК в место разрыва. Таким образом, если мы можем вносить двуцепочечные разрывы в ДНК в строго определённых местах, мы можем заставить клетки восстанавливать эти разрывы, при этом либо разрушая генетическую информацию, либо внося новую. И если бы мы смогли запрограммировать технологию CRISPR таким образом, чтобы разрыв в ДНК вносился в положении мутации или рядом с мутацией, вызывающей, например, муковисцидоз, мы могли бы заставить клетки исправить эту мутацию.
06:51
Вообще-то, геномная инженерия — не новая область, она развивается с 1970-х годов. У нас есть технологии для секвенирования ДНК, для копирования ДНК, даже для манипуляций с ДНК. И это весьма многообещающие технологии, но проблема в том, что они были либо неэффективны, либо слишком сложны в использовании, поэтому большинство учёных не могли использовать их в своих лабораториях или применять в клинических условиях. Таким образом, существовала потребность в такой технологии как CRISPR, потому что она относительно проста в использовании. Старые технологии геномной инженерии можно представить себе как необходимость перемонтировать ваш компьютер каждый раз, когда вы хотите запустить новую программу, тогда как технология CRISPR — это что-то вроде программного обеспечения для генома: мы легко можем её программировать, используя маленькие фрагменты РНК.
07:53
Как только сделан двуцепочечный разрыв, мы можем вызвать процесс восстановления и тем самым, возможно, достичь поразительных результатов, например, исправлять мутации, вызывающие серповидноклеточную анемию или болезнь Хантингтона. Лично я считаю, что первые случаи применения технологии CRISPR будут связаны с кровью, где относительно просто доставлять этот инструмент внутрь клеток, по сравнению с плотными тканями.
08:22
Прямо сейчас во многих проводимых работах метод применяют в животных моделях болезней человека, например, на мышах. Технологию используют для внесения очень точных изменений, что позволяет нам изучать то, как эти изменения клеточной ДНК влияют либо на ткань, либо, как здесь, на целый организм.
08:42
В этом примере технологию CRISPR использовали для разрушения гена путём внесения небольшого изменения в ДНК в гене, который отвечает за чёрную окраску шерсти этих мышей. Представьте, эти белые мышата отличаются от своих окрашенных братьев и сестёр всего только небольшим изменением одного гена во всём геноме, а в остальном они абсолютно нормальны. И когда мы секвенируем ДНК этих животных, то обнаруживаем, что изменение в ДНК произошло именно в том месте, где мы планировали, используя технологию CRISPR.
09:18
Также проводятся эксперименты и на других животных, у которых удобно создавать модели болезней человека, например, на обезьянах. И в этом случае мы обнаруживаем, что эти системы можно использовать для тестирования применения данной технологии к определённым тканям, например, для выяснения того, как доставлять инструмент CRISPR в клетки. Мы также хотим расширить наше понимание того, как можно контролировать способ восстановления ДНК после её разрыва, и выяснить, как можно контролировать и ограничивать нецелевое воздействие, или непреднамеренные эффекты, при использовании этой технологии.
09:55
Я полагаю, что мы станем свидетелями использования данной технологии в клинике, разумеется, у взрослых пациентов, в течение следующих 10 лет. Мне кажется вероятным, что за этот период будут проведены клинические исследования и, возможно, даже одобрены методы терапии, что очень воодушевляет. И благодаря этому воодушевлению, которое вызывает технология, к ней проявляют огромный интерес стартап-компании, созданные для того, чтобы превратить технологию CRISPR в коммерческий продукт, а также многие венчурные капиталисты,
10:26
инвестирующие в такие компании. Но мы также должны учитывать, что технологию CRISPR можно использовать для улучшения характеристик. Представьте, что мы могли бы попробовать конструировать людей, обладающих улучшенными характеристиками, например, более прочными костями, или меньшей склонностью к сердечно-сосудистым заболеваниям, или даже обладающих свойствами, которые, возможно, показались бы нам желательными, такими как другой цвет глаз или более высокий рост, что-то вроде этого. Если хотите, это «дизайнерские люди». Сейчас практически отсутствует генетическая информация, позволяющая понять, какие гены отвечают за эти признаки. Но важно понимать, что технология CRISPR дала нам инструмент для внесения таких изменений,
11:13
как только эти знания станут нам доступны. Это поднимает ряд этических вопросов, которые мы должны тщательно рассмотреть. И именно поэтому мы с коллегами призвали учёных всего мира сделать паузу в любых клинических применениях технологии CRISPR у эмбрионов человека, чтобы у нас было время тщательно рассмотреть все возможные последствия этого. И у нас есть важный прецедент для того, чтобы объявить такую паузу: в 1970-х годах учёные объединились для провозглашения моратория на использование молекулярного клонирования,
11:47
пока не будет тщательно проверена и подтверждена безопасность этой технологии. Так что пока генная инженерия людей откладывается, но это уже не научная фантастика. Созданные генной инженерией животные и растения уже существуют. И это накладывает на всех нас большую ответственность и необходимость учитывать как нежелательные последствия, так и роль преднамеренного влияния этого научного прорыва.
12:21
Спасибо!
12:22
(Аплодисменты) (Аплодисменты закончились)
Бруно Джуссани: Дженнифер, эта технология может иметь огромные последствия, как вы подчёркивали. Мы очень уважаем вашу позицию по объявлению паузы, или моратория, или карантина. У всего этого, конечно, есть терапевтические последствия, но есть и не связанные с лечением, и, по-видимому, именно они наиболее сильно притягивают интерес, особенно в СМИ. Вот один из последних выпусков журнала Economist: «Редактирование человечества». Здесь рассказывается только об улучшении свойств, не о лечении. Какую реакцию вы получили в марте от своих коллег в научном сообществе, когда попросили или предложили сделать паузу и задуматься обо всём этом?
Дженнифер Дудна: Мне кажется, коллеги были рады возможности открыто это обсудить. Интересно, что когда я разговаривала об этом с людьми, мои коллеги-учёные и не только высказывали самые разные точки зрения на этот счёт. Очевидно, что эта тема требует тщательного рассмотрения и обсуждения.
БДж: В декабре будет большая встреча, которую вы с коллегами созываете вместе с Национальной академией наук и другими. Чего именно вы ожидаете от этой встречи, с практической точки зрения?
ДжД: Я надеюсь, что будут обнародованы точки зрения многих людей и заинтересованных сторон, желающих ответственно обдумать использование этой технологии. Возможно, достигнуть консенсуса не удастся, но я полагаю, что мы должны по крайней мере понять, с какими проблемами столкнёмся в будущем.
БДж: Ваши коллеги, например, Джордж Чёрч из Гарварда, говорят: «Этические проблемы в основном являются вопросом безопасности. Мы снова и снова проводим тесты на животных, в лабораториях, и когда чувствуем, что опасности нет, переходим на человека». Это другой подход: мы должны использовать эту возможность и не должны останавливаться. Может ли это вызвать раскол в научном сообществе? То есть мы увидим, что часть людей отступят, потому что сомневаются в этичности, а другие просто пойдут вперёд, так как в некоторых странах контроль слабый или его вообще нет.
ДжД: Мне кажется, на любую новую технологию, особенно такую как эта, будет несколько разных точек зрения, и я думаю, что это абсолютно понятно. Полагаю, в конце концов эту технологию будут использовать для конструирования генома человека, но мне кажется, что делать это без тщательного рассмотрения и обсуждения рисков и возможных осложнений было бы безответственно.
БДж: Есть много технологий и других областей науки, которые развиваются по экспоненте, фактически как в вашей области. Я имею в виду искусственный интеллект, автономных роботов и так далее. Нигде, как мне кажется, кроме области автономных военных роботов, никто не инициировал аналогичную дискуссию в этих областях, призвав к мораторию. Не считаете ли вы, что ваша дискуссия может стать примером для других областей?
ДжД: Мне кажется, учёным сложно покидать лабораторию. Если говорить обо мне, мне не очень комфортно это делать. Но я действительно считаю, что раз я участвую в разработке этого, то данный факт накладывает на меня и моих коллег ответственность. И я бы сказала, что надеюсь, что другие технологии будут рассматриваться так же, как мы хотели бы рассматривать нечто, способное оказывать влияние в других областях, отличных от биологии.
15:44
БДж: Дженнифер, спасибо за то, что пришли на TED.
ДжД: Спасибо!
Читайте на Зожнике:






